3.2.2過氧化物交聯的化學機理
3.2.2.1過氧化物在二烯橡膠中的化學效應
過氧化物(如過氧化二異丙苯)在二烯橡膠(如天然橡膠)中的交聯作用往往不符合一級反應時間定律。相反,與秋蘭姆硫化作對比,在交聯劑(過氧化物)的減少、交聯鍵的形成和定伸強度的增加之間存在著直線關系16~72。因此假定在二烯橡膠中的過氧化物分解完全是同性分解,從而形成游離基分解產物,而交聯是按簡單的游離基機理進行,并無明顯的副反應。這種假定的最有力的證據是2,6-二甲基-辛二烯2,6與過氧化二異丙苯的反應,這個反應表明,其中碳氫化合物幾乎定量地轉化為其二聚物21。但是,在實際應用的大多數類似的化合物中,時間定律不是一級反應,而是在半級和二級之間(參見8.2.1.2.1)。因此,除過氧化物的同性分解外,也有一些異性分解,或者在形成的游離基和另一些配合劑之間存在著副反應。
就簡單的同性分解而言,可以設想下面的反應機理在硫化作用開始時,有機過氧化物首先分裂成兩個游離基(見方程229)。
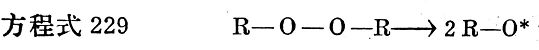
在烴聚合物存在時,這些游離基本身又被高聚物鏈的脫氫而再穩定,并將其游離基狀態轉移到烴鏈上(見方程式230):
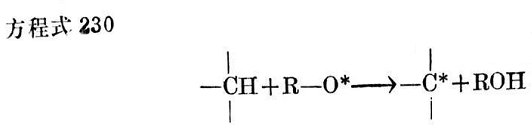
這樣形成的烴游離基能與類似的游離基反應而形成交聯鍵(見方程式231)。因此當用過氧化物時,就形成C—C交聯鍵2,而且根據2.3.2.2.2一節中所講的,可以指望有良好的耐高溫性能。
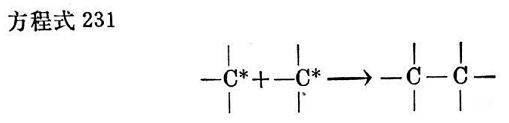
從上述說明可以斷定,過氧化物的每個分子形成一個交聯鍵。通過仔細研究高聚物鏈上產生游離基引發轉移的位置已經表明;受反應作用的第一個位置一般是a-次甲基碳原子713。因而可以設想,反應的方式如下(見方程式232~237):
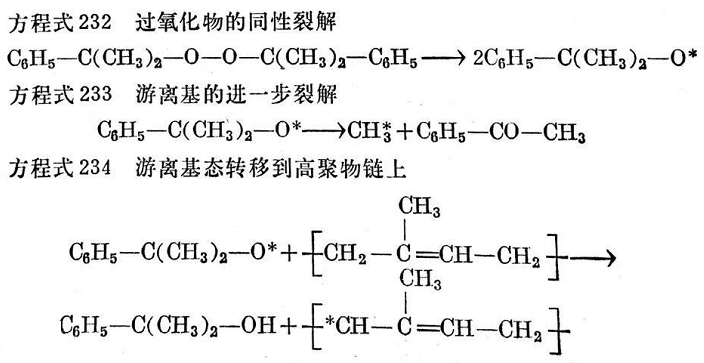
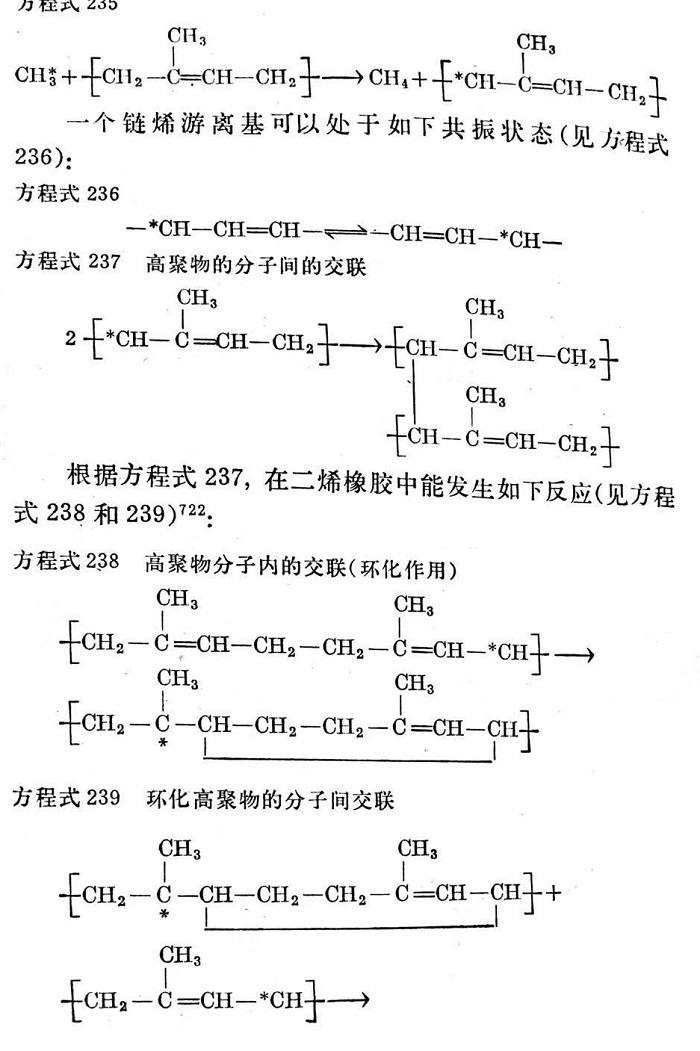
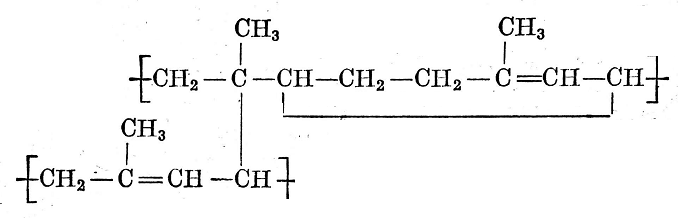
這里交聯作用可以在a-次甲基碳原子以外的位置上進行。
上述反應是最筒單的,它往往受過氧化物副反應的干擾而減少“交聯鍵產率”這意味著實際形成的交聯鍵的數目與理論上可能值有一定的關系。
最常見的副反應是由膠料中所含物質使過氧化物游離基失去活性。這些物質以硫黃、防老劑、增塑劑和填充劑最為明顯。過氧化物最容易與胺類起反應,因為與橡膠烴的脫氫作用相比,它只需要很小的活化能。這就使得一部分過氧化物游離基不可能參與硫化作用。
但是,副反應不限于過氧化物游離基,而且大分子鏈的誘導游離基也會出現副反應。
誘導游離基除再次與不是從高聚物中產生的游離基結合外,它們本身還能歧化而生成一個飽和的和一個不飽和的分子,最后發生鏈裂解,使聚合物解聚。這些反應也能降低交聯鍵產率。副反應的量主要取決于高聚物的性質和結構。例如聚異丁烯和丁基橡膠往往被過氧化物還原為油類物質(見3.2.2.2)。另一方面,硅橡膠、聚氨酯橡膠、二元乙丙膠和乙烯/醋酸乙烯酯共聚物等如已表明的那樣,雖然也可觀察到它們的分解傾向,但主要的還是交聯。
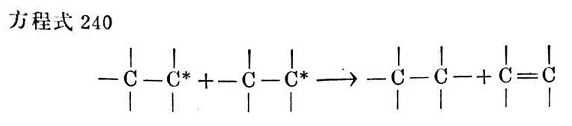
一種不能立即引起交聯的副反應,是一個橡膠鏈游離基被另一個游離基脫氫(不均衡性)(見方程式240):
游離基與氧,例如大氣中的氧的反應是硫化過程中另個重要的副反應,結果產生去活化作用。用二芳酰基過氧化物時,這一反應比用二烷基、烷基芳基和二芳烷基過氧化物稍微明顯一些。在熱空氣中往往能阻止膠料硫化,因為過氧化游離基與氧的反應往往比與橡膠鏈的反應更快。
用過氧化物交聯合成膠,如用過氧化二苯甲酰交聯順式一1,4-聚丁二烯時,按照謝勒6的說法,必然會有不能導致直接交聯的副反應就是過氧化物游離基在橡膠烴鏈上的加成(見方程式241)。然而,聚合時由1,2加成產生乙烯基側基,再與過氧化物反應產生側鏈游離基,而通過這些游離基能夠產生交聯731-734(見方程式242~243):
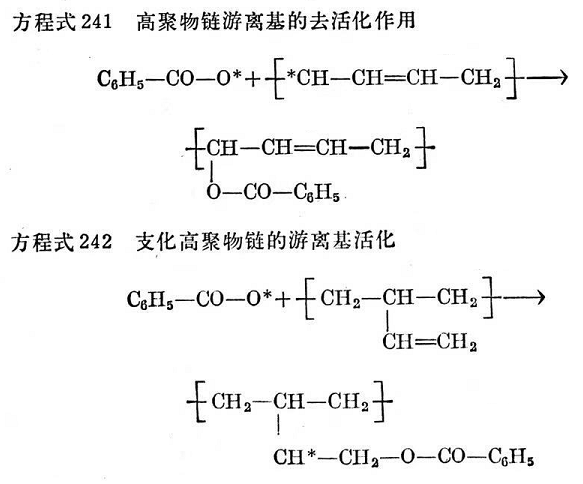
當E.法默(E. Farmer)和S.邁克爾(S. Michael)研究了環己烯和過氧化二苯甲酰的模擬反應之后,他們都證實了過氧化物游離基能結合到單體和二聚物上。在反應中生成了C6衍生物、二聚物、二聚體衍生物、苯甲酸和二氧化碳,這些研究證實了上述反應過程。橡膠與過氧化物之間的反應,象其它游離基交聯機理樣,可望出現環化作用(參見方程式238和239)。
經過詳細考察可以影響二烯游離基的環化反應后,這事實就比較容易理解(見方程式244):
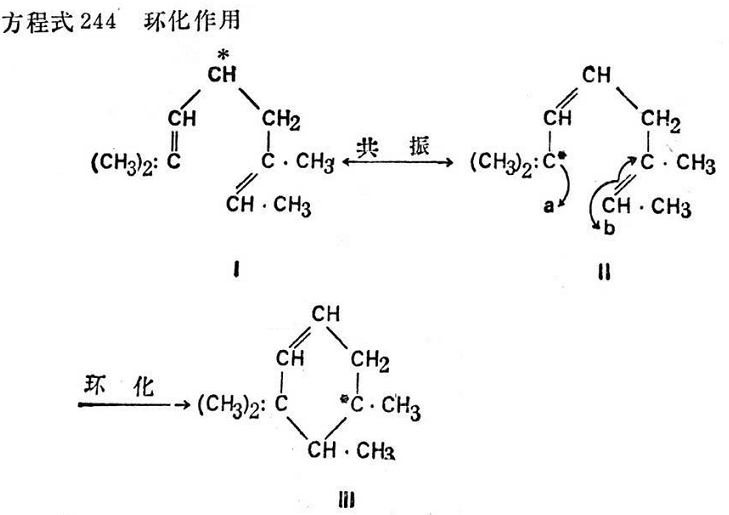
2,6-二甲基辛二烯-2,6游離基(I)與互變異構形式(I)處于共振狀態,這種異構形式由兩個碳原子a和b的電子遷移而有閉環傾向(環化作用)(Ⅲ)736,737。環化化合物本身可進一步與異戊間二烯基結合而形成交聯(見方程式245~247)。
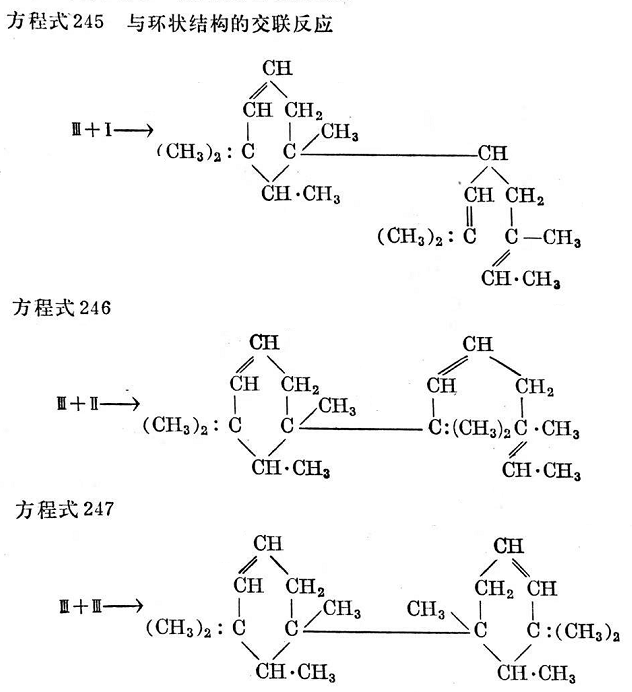
由此可見:用過氧化物以游離基形式交聯,不僅可望得到簡單的交聯結構,而且可以產生包括環化性質的比較復雜的交聯結構,通常這種環狀結構帶來較差的機械性能。
過氧化物在二烯橡膠交聯過程中,一般不能導致順反式異構化,但也有人說有這種現象產生。